LIGAÇÃO COVALENTE
Esse tipo de ligação
ocorre quando os átomos envolvidos tendem a receber elétrons. É como se dois
carros tivessem que dividir apenas quatro rodas.
Como é impossível que
todos os átomos recebam elétrons sem ceder nenhum, eles compartilham seus
elétrons, formando pares eletrônicos, como mostra a figura abaixo.
Cada par eletrônico é
constituído por um elétron de cada átomo e pertence simultaneamente aos dois
átomos.
Como não ocorre ganho nem
perda de elétrons, formam-se estruturas eletricamente neutras, denominadas
moléculas. Por esse motivo, essa ligação também é denominada molecular. Um
exemplo de uma molécula formada por ligações covalentes é a molécula de O2,
desenhada abaixo.
Esquematicamente, a ligação covalente
pode ser assim representada:
Por que os elétrons compartilhados mantêm os átomos unidos?
Os núcleos dos átomos que se unem para formar uma
molécula se repelem, pois possuem cargas elétricas de mesmo sinal. Um elétron
presente entre esses dois núcleos atrairá ambos, pois núcleo e elétron possuem
cargas de sinais opostos. A presença dos elétrons exerce uma atração
suficientemente alta para manter os núcleos unidos, apesar da repulsão entre
eles. Dessa forma, a ligação covalente ocorre pelo fato de a energia dos átomos
unidos é menos que a energia quando eles estão separados.
Será que é verdade?
Experimente você mesmo
Basta clicar na imagem e aproximar ou afastar os átomos.
Observe as variações de energia.
De acordo com o número de pares de
elétrons que são compartilhados, podemos ter ligações simples duplas ou
triplas. Quando apenas um par de elétrons é compartilhado, existe a formação de
uma ligação simples, como por exemplo, o caso da molécula de água.
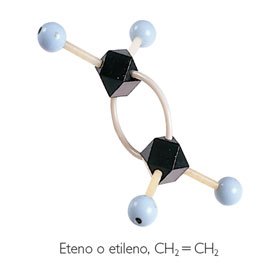
Quando dois pares de elétrons são
compartilhados, existe a formação de uma ligação dupla, como por exemplo, a
molécula de etileno.
Quando três pares de elétrons são
compartilhados, existe a formação de uma ligação tripla, como por exemplo, a
molécula de etino.
Podemos
citar outros exemplos de ligações simples, duplas e triplas:
Moléculas de nitrogênio N2
e dióxido de carbono CO2, respectivamente.
Muitas são as formas de representar as ligações, como podemos ver no exemplo a seguir.
Vamos aprender um pouco mais?
Basta clicar na imagem abaixo.
E que tal praticar um pouco?
Nesse jogo, você deve ser bom em caça palavras e conhecer bastante sobre LIGAÇÕES COVALENTES!
Vamos lá?
Clique na imagem.
O que diz sobre uma conversa periódica sobre ligações covalentes?
Clique na imagem
Não deixe de conferir também a vídeo aula sobre esse tema.








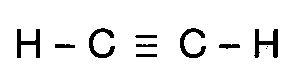






muito bom!
ResponderExcluirme ajudou muito com um trabalho escolar, vlw