Forças Intermoleculares
Forças de atração e
repulsão intermoleculares são interações que ocorrem entre as moléculas.
O estado da matéria
mais simples é o gás. No estado gasoso as moléculas encontram-se bastante
separadas, movimentando-se com muita liberdade. No estado líquido, elas se
encontram mais próximas, movimentando-se com menor liberdade. Já no estado
sólido, as moléculas estão ainda mais unidas e bem organizadas.
Que forças mantêm as
moléculas no estado sólido e liquido unidas?

As forças que mantêm as
moléculas no estado sólido e líquido unidas são chamadas, forças (interações ou
ligações) intermoleculares e podem ser de três tipos:
·
Interações dipolo-dipolo: decorrem da
atração entre as cargas parciais de suas moléculas.
·
Ligação de hidrogênio: ocorrem quando
átomos de hidrogênio estão ligados a átomos de oxigênio, nitrogênio e flúor, é
o tipo mais forte de força intermolecular.
·
Dipolo instantâneo-dipolo induzido: é
conhecido também como forças dipolo induzido- dipolo induzido ou forças de
dispersão de London. É a atração entre os dipolos elétricos instantâneos de
moléculas vizinhas e agem em todos os tipos de moléculas.
Vamos revisar?
Polaridade das ligações
O acúmulo de
cargas elétricas em determinada região é denominado pólo, que pode ser de dois
tipos:
Pólo negativo: (-) ou -ᵟ Pólo positivo: (-)
ou +ᵟ
Ligações iônicas
Em uma ligação
iônica ocorre transferência definitiva de elétrons, o que acarreta a formação
de íons positivos (cátions) ou negativos (ânions), os quais originam compostos
iônicos. Como todos os íons apresentam excesso de cargas elétricas positivas ou
negativas, eles sempre terão pólos. Portanto:
Toda
ligação iônica é uma ligação polar.
As ligações
iônicas apresentam máxima polarização.
Ligações covalentes
Nessas
ligações, a existência de pólos está associada à deformação da nuvem eletrônica
e depende da diferença de eletronegatividade entre os elementos.
Quando a
ligação covalente ocorre entre átomos de mesma eletronegatividade, não ocorre
distorção da nuvem eletrônica, ou seja, não ocorre formação de pólos. Assim,
essas ligações são denominadas apolares. Alguns exemplos de moléculas apolares
estão apresentados a seguir:
Na ligação
covalente entre átomos de eletronegatividades diferentes, ocorre deformação da
nuvem eletrônica em decorrência do acúmulo de carga negativa (-ᵟ) em torno do
elemento de maior eletronegatividade. Essas ligações são denominadas polares. Um exemplo de uma ligação
covalente polar é representado pela molécula de HCl:
Para comparar a
intensidade de polarização das ligações, utilizamos a escala de
eletronegatividade de Pauling:
Eletronegatividade
crescente
Quanto maior for a
diferença de eletronegatividade, maior será a
polarização da ligação.
A
partir dos itens já discutidos, podemos estabelecer a seguinte relação:
A
polaridade de uma ligação é caracterizada por uma grandeza denominada momento dipolar (μ), ou dipolo elétrico, que normalmente é
representada por um vetor orientado no sentido do elemento menos
eletronegativo para o elemento mais
eletronegativo. Assim, o vetor é orientado do pólo positivo para o pólo
negativo.
Imagine se nós pudéssemos observar a nuvem eletrônica de uma molécula polar. Veríamos que essa nuvem estaria deslocada para o átomo mais eletronegativo, como observamos na animação abaixo.
A bolinha verde representa o átomo mais eletronegativo, e é por isso que a nuvem eletrônica se desloca para próximo dele. O lugar onde a maioria dos elétrons se encontram é o pólo negativo da molécula, e o outro, que apresenta falta de elétrons, é o pólo positivo. Sendo assim, a molécula é considerada como POLAR.
Agora, se pudéssemos observar a nuvem eletrônica de uma molécula apolar, veríamos que a nuvem eletrônica não se desloca pra nenhum dos lados da molécula. Observe a animação.
Como os dois átomos são iguais, a nuvem eletrônica não é deslocada para nenhum dos lados. Sendo assim, não existe pólo positivo e nem pólo negativo. Dessa forma, a molécula é considerada como APOLAR.
E que tal usarmos um simulador para testar esses conceitos?
Então clique na imagem, altere a eletronegatividade dos elementos, observe a polaridade e o momento dipolar. Não deixe de observar qual é o caráter da ligação. Escreva um comentário com as suas conclusões!
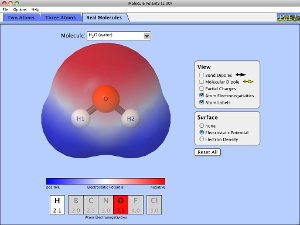
...DESAFIO...
Use o simulador abaixo e tente descrever o por que dos comportamentos observados.
Por que algumas substâncias são atraídas pelas barrinhas carregadas e outras não?
Não deixe de assistir os vídeos dos experimentos realizados no laboratório (com a barra de plástico). Para a animação acontecer SEGURE o botão PLAY pressionado, ou aperte o botão AVANÇAR (>>>). Troque os bastões e tente explicar o comportamento das diversas substâncias quando interagem com o bastão de ferro.
Como as substâncias reagem ao bastão de ferro? Por qual motivo isso acontece?
Deixe sua resposta por meio de comentários!










Qual a bibliografia?
ResponderExcluir